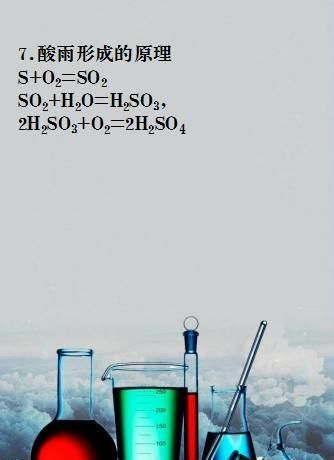













酸的二十条必考内容
1.酸的定义:只有在电离时生成的阳离子全部都是H+的化合物才是酸,KHSO4就不是酸。
KHSO4=K++H++SO42-(因为KHSO4发生电离时产生的阳离子有K+和H+两种)
2.常见的三强酸:HCl、H2SO4、 HNO3 人的胃液里含有HCl,汽车常用的蓄电池里含有H2SO4,食醋中含有CH3COOH,酸雨中含有H2SO4和 HNO3 。正常雨水中含有碳酸(H2CO3)
CO2+H2O=H2CO3
3.正常的雨水pH<7,酸雨的pH<5.6.
厨房清洁剂pH>7,厕所清洁剂pH<7
4.溶液中H+浓度越高,酸性就越强,pH就越小。
增大酸性溶液pH的方法:①加水;②加碱(NaOH等);③加活泼金属(Mg等);④加盐(CaCO3等)⑤加金属氧化物(氧化铜等)
5.测定pH的最简单方法是使用pH试纸。
pH试纸的使用步骤:在白瓷板或玻璃片上放一小片pH试纸,用玻璃棒将待测液体滴到pH试纸上,变色后,与标准比色卡对照,读出数值。
测定pH的最准确方法是使用pH计。
6.使用pH试纸时的注意事项:
①不能把pH试纸浸在待测液体中。
②pH试纸不能用水润湿。
③pH试纸测出的pH值是整数。
7.酸雨形成的原理
SO2+H2O=H2SO3,2H2SO3+O2=2H2SO4
8.浓硫酸的稀释:把浓硫酸沿器壁慢慢注入,并不断用玻璃棒搅拌(目的:加快溶解、散热)。
9.浓硫酸具有吸水性,常用来做气体的干燥剂。但浓硫酸不能干燥氨气等碱性气体。
H2SO4+2NH3=(NH4)2SO4
10.打开浓盐酸的瓶塞,会有白雾出现,是因为:挥发的氯化氢气体极易溶于水,挥发时溶解的氯化氢与水蒸气形成了盐酸的小液滴。
11.酸的分类与命名
含氧酸(命名“某酸”)
H2SO4(硫酸)、H2CO3(碳酸)、HNO3(硝酸)、H2SO3(亚硫酸)
无氧酸(命名“氢某酸”)
HCl(盐酸,学名氢氯酸)、HF(氢氟酸)、H2S(氢硫酸)
12.敞口放置的浓盐酸浓硫酸的变化
浓盐酸质量减小,溶质质量分数减小(挥发性)
浓硫酸质量变大,溶质质量分数减小(吸水性)
13.酸有相同的化学性质是因为酸在水中都能电离出H+,有不同的化学性质是因为能电离出的酸根离子不同。
14.酸+活泼金属 → 盐+氢气(置换反应)
这里不包括浓硫酸和硝酸。
Fe+2HCl=FeCl2+H2↑
Fe+H2SO4=FeSO4+H2↑
【现象】铁表面有气泡产生;溶液由无色逐渐变为浅绿色(Fe2+的盐溶液呈浅绿色)。
15.酸+金属氧化物 → 盐+水(复分解反应)
a) 金属氧化物可以是活泼金属的氧化物和不活泼金属的氧化物。因为生成物有水,符合复分解反应的发生条件,所以反应一定发生。
b) Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
【现象】铁锈逐渐溶解消失;溶液由无色逐渐变成黄色(Fe3+的盐溶液呈黄色)。
c) CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
【现象】黑色粉末逐渐溶解消失;溶液由无色逐渐变成蓝色(Cu2+的盐溶液呈蓝色)
16.酸+碱 → 盐+水(复分解反应、中和反应)
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O
17.酸+盐 → 新酸+新盐(复分解反应)
碳酸盐都能与酸反应:
CaCO3+2HCl=CaCl2+H2O+CO2↑
除硫酸钡以外的钡盐都能与硫酸反应:
BaCl2+H2SO4=BaSO4↓+ 2HCl
硝酸银能与盐酸反应:
AgNO3+HCl=HNO3+AgCl↓
18.浓硫酸有强腐蚀性,浓硫酸沾到皮肤上,要大量的清水冲洗,再涂上3%~5%的NaHCO3溶液。
19.盐酸的用途:金属表面除锈、制药;
硫酸的用途=制造化肥、农药、染料、冶炼金属、金属表面除锈。
20.常考的化学方程式:
Zn+H2SO4=ZnSO4+H2↑(实验室制氢气)
Fe2O3+6HCl=2FeCl3+3H2O(除铁锈)
CuO+H2SO4=CuSO4+H2O(工业制硫酸铜)
Al(OH)3+3HCl=AlCl3+3H2O (治疗胃酸过多)
CaCO3+2HCl=CaCl2+H2O+CO2↑(实验室制CO2)
BaCl2+H2SO4=BaSO4↓+ 2HCl(生成不溶于稀硝酸的白色沉淀)
AgNO3+HCl=HNO3+AgCl↓(生成不溶于稀硝酸的白色沉淀)#家长百问百答##优质自荐#