前言
“慢加急性肝衰竭(ACLF)主题月评”是中国慢(加急)性肝衰竭联盟受《国际肝病》编辑部邀请,制作的ACLF相关学术月评专栏。本专栏每月以ACLF某一特定领域为主题展开,旨在普及ACLF的概念及意义、帮助读者快速了解有关领域的进展。希望本专栏对无论是需要了解相关领域热点的肝病专家及研究人员,或是需要实用知识、活跃于临床一线的医务工作者,均能有所裨益。
ACLF中的全身炎症
本期重点阐述了ACLF全身炎症研究中的最新进展。最后,对本月(2021.10.21-2021.11.20)PUBMED上更新的ACLF相关重要文献进行简评。

中国慢(加急)性肝衰竭联盟(Chinese Acute-on-chronic liver failure Consortium,Ch-CLIF-C)是由上海交通大学附属仁济医院消化内科李海教授牵头,由全国14家三甲医院感染科/肝病中心共同参与成立的肝病科研合作团队,致力于探索慢加急性肝衰竭(ACLF)的发病机制和制定基于高循证等级的乙型肝炎高流行区ACLF诊断标准。目前团队开展了全球已报道入组数最多的ACLF前瞻性多中心队列研究“CATCH LIFE”(Chinese AcuTe-on-CHronic LIver FailurE),包含2个大型队列(入组2600例的探索队列与入组1370例的验证队列)。

浙大一院感染科副主任医师、博士生导师,浙江省临床免疫学会青委副主任委员,浙江省医学会肝病分会青年委员,浙江省数理学会肝病分会青年委员。从事乙肝重症肝病研究,承担国家自然基金2项、参与国家十三五重大专项课题研究,在BMJ、Hepatology、Journal of Hepatology等医学期刊上发表学术论文70余篇,为30多本医学期刊审稿。
主题述评
ACLF是各种诱因引起的慢性肝病急性加重,导致器官衰竭和短期高病死率的危重症。目前认为全身炎症是ACLF关键的病理生理特征,同时是推动肝外器官功能衰竭、导致病情进展和死亡的主要机制,也是ACLF治疗“黄金窗口期”的干预靶点。
一、全身炎症定义和诊断
全身炎症或系统性炎症(Systemic Inflammation)是指宿主免疫系统对病原体侵袭或组织损伤的过度应答,形成炎症级联反应,释放大量的炎症介质,导致原发感染或损伤部位外的器官功能障碍1。感染、外伤、手术、缺血再灌注损伤、恶性肿瘤等均可诱发全身炎症。全身炎症反应综合征(Systemic Inflammatory Response Syndrome,SIRS)定义了感染相关的全身炎症,其诊断标准包括(满足以下任意两项)2:1)体温超过38℃或低于 36℃;2)心率大于90次/分钟;3)呼吸频率大于20次/分钟或CO2分压小于32 mmHg;(4)白细胞计数>12000/μL或<4000/μL,或未成熟粒细胞大于10%。
SIRS标准简单易操作,因此曾被广泛应用于脓毒症的诊断,但大量研究表明SIRS并不能准确反映全身炎症,其敏感性和特异性仍有欠缺3。全身炎症也被认为是ACLF患者发生肝外器官衰竭的关键病理生理机制,但SIRS标准在ACLF中的应用有更大的局限性。譬如,ACLF患者的血流高动力循环、非选择性β-受体阻滞剂(Non-selective β-blocker, NSSB)的使用及合并中到大量胸腹水均会干扰心率或呼吸频率的判断。此外,合并肝硬化的ACLF患者脾功能亢进常引起白细胞数减少,也进一步干扰了SIRS标准的应用4。因此,目前仍亟需明确ACLF患者中全身炎症的诊断标准,其对于临床转归的判断、病理机制的研究及临床干预研究的开展均有重要意义。
近年来,国内外研究报道中性粒细胞-淋巴细胞比例(Neutrophil-lymphocyte ratio,NLR)、可溶性CD163、CRP、细胞因子等炎症标志物是反映ACLF患者全身炎症的可靠指标并能独立预测临床转归,为全身炎症诊断标准的建立奠定了基础5。
二、全身炎症的形成机制
细菌感染和肝炎发作是ACLF的主要诱因。相对应的,目前认为病原体相关分子模式(Pathogen-associated molecular patterns, PAMPs)及肝细胞、肝脏非实质细胞或细胞外基质崩解释放的损伤相关分子模式(Damage associated molecular patterns,DAMPs)通过特定的模式识别受体(Pattern recognition receptors,PRRs)如Toll样受体(Toll-like receptors,TLRs)、核苷酸结合寡聚化结构域NOD样受体[Nucleotide binding and oligomerization domain(NOD)-like receptors,NLRs]、视黄酸诱导基因-I样受体(Retinoic acid-inducible gene I-like receptors,RLRs)、DNA感应受体、C型凝集素等对先天免疫细胞的激活作用在诱导ACLF的全身炎症中起主要作用。
目前已发现的、在ACLF中可能起作用的PAMPs和DAMPs包括脂多糖(LPS)和IL-33等6,7,未来仍需要进一步寻找更多的相关分子模式。单核细胞和中性粒细胞是外周循环主要的先天免疫细胞群,也被认为是介导ACLF全身炎症的主要效应细胞,其表型、内型和功能均发生显著的改变7-9。另一方面,遗传易感性也是影响全身炎症形成的重要因素。有研究发现IL-1β和IL-1ra的单核苷酸多态性与ACLF的全身炎症程度相关10。
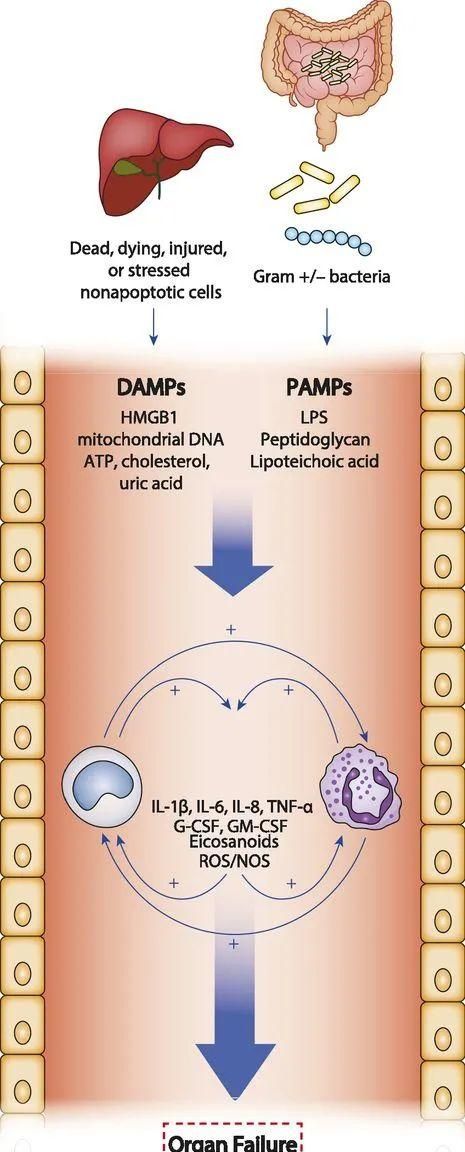
图1.ACLF全身炎症形成示意图
革兰阳性/阴性细菌释放PAMP分子,死亡肝细胞及非实质细胞释放DAMP分子,进入外周循环。这些分子与先天免疫系统细胞如单核细胞和中性粒细胞的受体相互作用,导致炎症细胞因子如IL-1β、IL-6、IL-8和 TNF-α等、类二十烷酸、活性氧和NO的产生。这些炎症介质的协同作用导致器官低灌注、组织缺血、组织细胞功能障碍/坏死和高凝状态等机制诱发器官衰竭。Joan Clària, et al. J Immunol, 2016; 197(10):3755-3761.
三、全身炎症作用于器官功能的机制
总的来说,目前认为全身性炎症通过三种不同的途径导致器官衰竭11:1)直接免疫损伤:例如,中性粒细胞释放的胞外捕获网(Neutrophil extracellular traps,NETs)可直接造成实质细胞的氧化应激损伤,也可以作用于器官的血管内皮,促进血栓形成,导致微循环障碍和缺血损伤;2)代谢失衡:全身炎症反应竞争性地将人体的能量及营养供应用于激活的免疫系统,以维持剧烈的炎症应答,而在此过程中,非免疫器官的能量及营养供应相对不足,而导致功能障碍,研究表明ACLF患者外周器官存在显著线粒体活性的损害和代谢抑制,与器官衰竭密切相关12;3)器官特异性机制协同作用:全身炎症反应可进一步加重原有的器官特异性损害,例如炎症细胞因子可导致血脑屏障对血氨及其他神经毒素通透性增加,同时活化脑小胶质细胞,加重肝性脑病13。
四、全身炎症的治疗
目前认为全身炎症与ACLF患者的肝外器官衰竭存在因果关联,因此全身炎症被认为是ACLF早期干预、阻断病情发展的关键靶点。潜在的治疗手段包括:
(1)人工肝血液净化:非生物型人工肝血液净化系统可成功清除炎症因子,并减轻循环单核细胞的炎症应答14,15。但何种非生物型人工肝模式如血液灌流、血浆置换等有最优的抑制全身炎症的效果仍需进一步研究。此外,人工肝清除炎症因子的持续效果和远期作用也有待阐明;
(2)糖皮质激素:糖皮质激素是广谱的细胞及体液免疫抑制剂,在乙肝相关ACLF中有较多应用,但其应用指征、剂量及疗程尚需进一步规范16;
(3)人血清白蛋白:人血清白蛋白可显著抑制失代偿肝硬化患者的全身炎症17,其可被免疫细胞内吞并与调控内体上的TLR信号传导途径从而调节免疫细胞应答18。目前应用大剂量白蛋白治疗ACLF全身炎症的临床试验正在进行中。
(4)干细胞治疗:人骨髓间充质细胞可通过旁分泌作用减轻肝衰竭的炎症因子应答19,并可进一步改善肝功能和提高生存率20。
(5)其他有潜在治疗作用的药物包括NSSB、他汀类药物、TLR-4拮抗剂等。
然而,受研究纳入标准、ACLF人群异质性和具体治疗方案的影响,这些治疗方法的疗效在不同的研究中有所区别。因此,上述方法治疗ACLF全身炎症的确切疗效和安全性证据仍需在今后更严格的随机临床试验中证实。此外,如何抑制过度的全身炎症而不引起显著的免疫抑制和不增加继发感染风险仍需要进一步研究。
参考文献:
1. Chakraborty RK, Burns B. Systemic Inflammatory Response Syndrome. 2021.
2. American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. Crit Care Med. 1992;20(6):864-874.
3. Fernando SM, Reardon PM, Rochwerg B, et al. Sepsis-3 Septic Shock Criteria and Associated Mortality Among Infected Hospitalized Patients Assessed by a Rapid Response Team. Chest. 2018;154(2):309-316.
4. Cazzaniga M, Dionigi E, Gobbo G, Fioretti A, Monti V, Salerno F. The systemic inflammatory response syndrome in cirrhotic patients: relationship with their in-hospital outcome. J Hepatol. 2009;51(3):475-482.
5. Mookerjee RP. Prognosis and Biomarkers in Acute-on-Chronic Liver Failure. Semin Liver Dis. 2016;36(2):127-132.
6. Du XX, Shi Y, Yang Y, et al. DAMP molecular IL-33 augments monocytic inflammatory storm in hepatitis B-precipitated acute-on-chronic liver failure. Liver Int. 2018;38(2):229-238.
7. Wu W, Sun S, Wang Y, et al. Circulating Neutrophil Dysfunction in HBV-Related Acute-on-Chronic Liver Failure. Front Immunol. 2021;12:620365.
8. Wu W, Yan H, Zhao H, et al. Characteristics of systemic inflammation in hepatitis B-precipitated ACLF: Differentiate it from No-ACLF. Liver Int. 2018;38(2):248-257.
9. Li J, Liang X, Jiang J, et al. PBMC transcriptomics identifies immune-metabolism disorder during the development of HBV-ACLF. Gut. 2021.
10. Alcaraz-Quiles J, Titos E, Casulleras M, et al. Polymorphisms in the IL-1 gene cluster influence systemic inflammation in patients at risk for acute-on-chronic liver failure. Hepatology. 2017;65(1):202-216.
11. Arroyo V, Angeli P, Moreau R, et al. The systemic inflammation hypothesis: Towards a new paradigm of acute decompensation and multiorgan failure in cirrhosis. J Hepatol. 2021;74(3):670-685.
12. Moreau R, Clària J, Aguilar F, et al. Blood metabolomics uncovers inflammation-associated mitochondrial dysfunction as a potential mechanism underlying ACLF. J Hepatol. 2020;72(4):688-701.
13. Shawcross DL, Sharifi Y, Canavan JB, et al. Infection and systemic inflammation, not ammonia, are associated with Grade 3/4 hepatic encephalopathy, but not mortality in cirrhosis. J Hepatol. 2011;54(4):640-649.
14. Chen JJ, Huang JR, Yang Q, et al. Plasma exchange-centered artificial liver support system in hepatitis B virus-related acute-on-chronic liver failure: a nationwide prospective multicenter study in China. Hepatobiliary Pancreat Dis Int. 2016;15(3):275-281.
15. Maiwall R, Bajpai M, Choudhury AK, et al. Therapeutic plasma-exchange improves systemic inflammation and survival in acute-on-chronic liver failure: A propensity-score matched study from AARC. Liver Int. 2021.
16. Jia L, Xue R, Zhu Y, et al. The efficacy and safety of methylprednisolone in hepatitis B virus-related acute-on-chronic liver failure: a prospective multi-center clinical trial. BMC Med. 2020;18(1):383.
17. Fernández J, Clària J, Amorós A, et al. Effects of Albumin Treatment on Systemic and Portal Hemodynamics and Systemic Inflammation in Patients With Decompensated Cirrhosis. Gastroenterology. 2019;157(1):149-162.
18. Casulleras M, Flores-Costa R, Duran-Güell M, et al. Albumin internalizes and inhibits endosomal TLR signaling in leukocytes from patients with decompensated cirrhosis. Sci Transl Med. 2020;12(566).
19. Shi D, Zhang J, Zhou Q, et al. Quantitative evaluation of human bone mesenchymal stem cells rescuing fulminant hepatic failure in pigs. Gut. 2017;66(5):955-964.
20. Lin BL, Chen JF, Qiu WH, et al. Allogeneic bone marrow-derived mesenchymal stromal cells for hepatitis B virus-related acute-on-chronic liver failure: A randomized controlled trial. Hepatology. 2017;66(1):209-219.
近1月ACLF的研究统计及简评
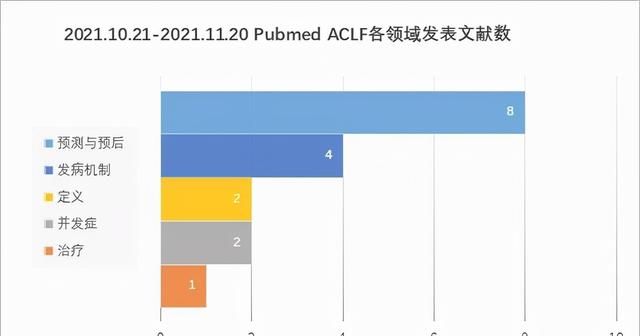
2021.10.21-2021.11.20在Pubmed上共在线发表关于ACLF综述+论著文献共17篇,涉及定义、并发症、发病机制、预测与预后、治疗,具体分布见下图。
01
Nationwide survey for patients with acute-on-chronic liver failure occurring between 2017 and 2019 and diagnosed according to proposed Japanese criteria. J Gastroenterol. 2021 Nov 5. doi: 10.1007/s00535-021-01834-8. (IF=7.527)
简述:该研究利用日本ACLF诊断标准,即Child-Pugh评分为5-9的肝硬化患者在急性损伤后28天内出现肝功能衰竭[血清胆红素水平≥5.0 mg/dL 且凝血酶原时间国际标准化率(INR)≥ 1.5 ],纳入了 2017 年至 2019 年的日本ACLF 患者进行分析。在纳入的183例ACLF患者中,酒精性肝硬化和大量酒精摄入是最主要的慢性病因(114,62%)和急性诱因(75,41%),其中有68例(37%)也符合重症酒精性肝炎诊断标准。ACLF患者的90天无肝移植生存率为48%。多因素分析显示,患者年龄和器官功能衰竭数量也与ACLF患者死亡相关。
简评:日本的ACLF人群接近于欧美国家,以酒精性肝病相关ACLF为主,这也是我国未来在病毒性肝炎控制后发展的趋势。日本ACLF诊断标准强调基线Child-Pugh评分为5-9即Child-A到B级的患者,是为了区分ACLF和慢性肝衰竭。
02
Gene profiling of Toll-like receptor signalling pathways in neutrophils of patients with acute-on-chronic liver failure. J Transl Med. 2021 Nov 13;19(1):465. doi: 10.1186/s12967-021-03135-3. (IF=5.531)
简述:中性粒细胞在抵御病原体感染和器官/组织损伤方面起着至关重要的作用,但其在肝硬化及ACLF发病机制中的作用研究较少。本研究纳入代偿性肝硬化(n=9)、失代偿性肝硬化(n=9)和ACLF(n=9)患者,研究在肝硬化-ACLF发展中患者中性粒细胞中TLR信号通路的改变。研究发现代偿性和失代偿肝硬化患者中性粒细胞中分别有17个和6个基因上调,主要分布在衔接子、TLR相互作用蛋白和下游通路中。在ACLF患者的中性粒细胞中观察到TLR信号通路基因下调的趋势。TLR3、IFNG、IL1B、TBK1、CCL2和LTA在中性粒细胞中下调,而IL-10表达则显著上调。
简评:目前认为免疫功能低下是ACLF晚期的免疫特征,尤其是在EASL-CLIF标准下的ACLF患者中表现较为明显。此研究发现中性粒细胞的TLR通路基因有下调趋势,而抑炎因子IL-10则显著上调,提示中性粒细胞的抵御病原体感染功能可能受到抑制,为ACLF患者的高继发感染风险提供了机制上的初步证据。
03
Development and Validation of a Novel Risk Prediction Model Using Recursive Feature Elimination Algorithm for Acute-on-Chronic Liver Failure in Chronic Hepatitis B Patients With Severe Acute Exacerbation. Front Med (Lausanne). 2021 Nov 1;8:748915. doi: 10.3389/fmed.2021.748915. (IF=5.091)
简述:该研究纳入342例慢乙肝严重急性发作患者(CHB-SAE)和两个外部队列,利用新递归特征消除算法选择最佳因素组合来开发和验证分类回归模型,用以预测慢乙肝严重急性发作患者的ACLF进展风险以及病死率。研究鉴定了凝血酶原时间(PT)、年龄、总胆红素 (Tbil) 和丙氨酸氨基转移酶(ALT)四个预测因子,并开发了预测ACLF进展的PATA 预测模型,其受试者工作特征曲线下面积为(AUROC)0.959 (95%CI:0.941~0.977),两个外部验证队列中的AUC分别为0.932(95%CI:0.876~0.987)和0.905(95%CI:0.826~0.984)。ACLF风险预测概率的校准曲线显示PATA模型预测与实际观察之间的最佳一致性。对不同风险组进行预测分层后,PATA模型的预测90天死亡率的C指数为0.720(0.675~0.765),MELD评分模型为0.549(0.506~0.592)和Child-Turcotte-Pugh评分系统为0.648(0.581~0.715)。作者进一步开发了可便捷使用的云服务器上的在线应用程序。
简评:该研究建立了一个可准确预测ACLF发生的预测模型,并建立了易于使用的在线应用程序,对临床实践有较大价值。但研究提出的模型中的两个预测因子(Tbil和PT)本身就是ACLF诊断标准的成分(文中使用的APASL标准,PT同INR高度正相关),因此其对ACLF发展的真实预测作用需进一步探讨。此外,验证队列样本较少,未来需要进一步证实在真实世界中的应用价值。
各研究中心PI